http://www.liankebio.com/article-information_Dynamic-225.html
作者:联科生物 发布日期:2013-08-22 06:00
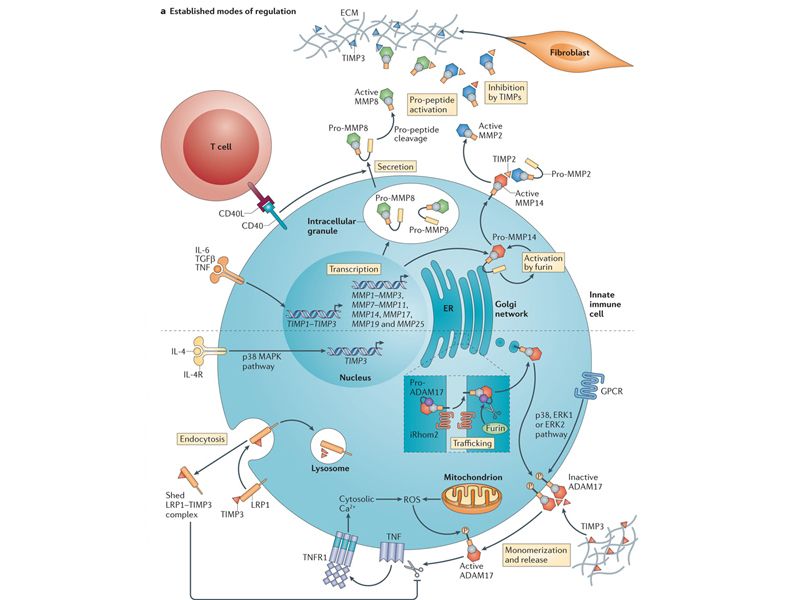
.疟疾感染引起血液DC细胞凋亡 疟原虫每年在全球造成大量患者感染,故其疫苗研制有重要意义,而疫苗研究离不开对相关免疫细胞的深入了解。澳大利亚一项研究发现疟原虫感染引起患者血液中的树突状细胞(DC)的凋亡及数量的显著减少,这可能与患者体内IL-10水平的升高密切相关。请参见Jem官网:http://jem.rupress.org/content/210/8/1 635.abstract 2.MK5通过Rag调控B细胞发育Rag基因调控T/B细胞发育,是最重要的免疫相关基因之一。转录因子Foxp1调控Rag的表达,但是其调控机制(尤其在B细胞中)并不清楚。最新研究发现MAPK活化蛋白激酶(MK5)是B细胞中Foxo1上游一个重要调控分子,通过MK5→Foxo1→Rag通路调控B细胞的发育。请参见 Jem官网: http://jem.rupress.org/content/210/8/1621.abstract 3.CD28通过EDC1调控T细胞活化 疟原虫每年在全球造成大量患者感染,故其疫苗研制有重要意义,而疫苗研究离不开对相关免疫细胞的深入了解。澳大利亚一项研究发现疟原虫感染引起患者血液中的树突状细胞(DC)的凋亡及数量的显著减少,这可能与患者体内IL-10水平的升高密切相关。请参见Jem官网:http://jem.rupress.org/content/210/8/1 635.abstract 2.MK5通过Rag调控B细胞发育Rag基因调控T/B细胞发育,是最重要的免疫相关基因之一。转录因子Foxp1调控Rag的表达,但是其调控机制(尤其在B细胞中)并不清楚。最新研究发现MAPK活化蛋白激酶(MK5)是B细胞中Foxo1上游一个重要调控分子,通过MK5→Foxo1→Rag通路调控B细胞的发育。请参见 Jem官网: http://jem.rupress.org/content/210/8/1621.abstract 3.CD28通过EDC1调控T细胞活化 共刺激分子CD28是T细胞活化重要的信号分子,但其启动T细胞活化的机制并不明确,最新研究发现CD28信号能够诱导转录因子DEC1的表达,从而参与CD4 T细胞的活化。而由于DEC1能够调控细胞因子表达,故其活化亦是T细胞相关自身免疫病发病所必须的。请参见 Jem官网:http://jem.rupress.org/content/210/8/1 603.abstract 共刺激分子CD28是T细胞活化重要的信号分子,但其启动T细胞活化的机制并不明确,最新研究发现CD28信号能够诱导转录因子DEC1的表达,从而参与CD4 T细胞的活化。而由于DEC1能够调控细胞因子表达,故其活化亦是T细胞相关自身免疫病发病所必须的。请参见 Jem官网:http://jem.rupress.org/content/210/8/1 603.abstract 4.CD154-CD40调控CD8 T细胞的机制 4.CD154-CD40调控CD8 T细胞的机制  研究表明CD4 T细胞通过CD40(DC表面)-CD154(CD4 T表面)的相互作用活化CD8 T细胞。但一项研究却发现,CD4 T细胞的剔除并没有显著影响初始CD8 T细胞的活化,这可能是由于CD154–CD40作用同时亦作用于抑制性Treg从而使得两种功能相互抵消。请参见 Jem官网:http://jem.rupress.org/content/210/8/1 591.abstract 研究表明CD4 T细胞通过CD40(DC表面)-CD154(CD4 T表面)的相互作用活化CD8 T细胞。但一项研究却发现,CD4 T细胞的剔除并没有显著影响初始CD8 T细胞的活化,这可能是由于CD154–CD40作用同时亦作用于抑制性Treg从而使得两种功能相互抵消。请参见 Jem官网:http://jem.rupress.org/content/210/8/1 591.abstract 5.USP18通过泛素化修饰调控Th17分化 5.USP18通过泛素化修饰调控Th17分化 细胞信号的可逆泛素修饰是传递胞外信号的重要机制之一,泛素特异性酶USP18之前被证实调控了IFN-I信号,而一项新的研究发现在Th17细胞中,USP18亦能够通过对TAK1–TAB1复合物的去泛素化,抑制NF-κB和NFAT信号活化,从而调控Th17的分化。请参见 Jem官网:http://jem.rupress.org/content/210/8/1 575.abstract6.儿童期腮腺炎病毒感染导致成年男性不育的机制 细胞信号的可逆泛素修饰是传递胞外信号的重要机制之一,泛素特异性酶USP18之前被证实调控了IFN-I信号,而一项新的研究发现在Th17细胞中,USP18亦能够通过对TAK1–TAB1复合物的去泛素化,抑制NF-κB和NFAT信号活化,从而调控Th17的分化。请参见 Jem官网:http://jem.rupress.org/content/210/8/1 575.abstract6.儿童期腮腺炎病毒感染导致成年男性不育的机制  南京大学模式动物研究所李朝军教授和高翔课题组共同发现,腮腺炎病毒感染导致男性睾丸中调节蛋白质香叶基香叶基二磷酸合成酶(GGPPS)的异戊二烯化修饰,从而引起其表达量显著下降,最终引起炎症被放大并导致患者成年不育。请参见 Jem官网:http://jem.rupress.org/content/210/8/1 559.abstract 南京大学模式动物研究所李朝军教授和高翔课题组共同发现,腮腺炎病毒感染导致男性睾丸中调节蛋白质香叶基香叶基二磷酸合成酶(GGPPS)的异戊二烯化修饰,从而引起其表达量显著下降,最终引起炎症被放大并导致患者成年不育。请参见 Jem官网:http://jem.rupress.org/content/210/8/1 559.abstract 7.转录因子TAL1的致癌机制 7.转录因子TAL1的致癌机制 约60%的人类T细胞急性淋巴细胞白血病(T-ALL)患者标本内能检测到致癌转录因子TAL1/SCL,但其致癌机制并不清楚。英国与新加坡科学家的一项研究揭示,TAL1通过活化miR-233阻断了FBXW7这一基因的表达,而FBXW7则是(T-ALL)中一个非常重要的肿瘤抑制基因。请参见 Jem官网:http://jem.rupress.org/content/210/8/1545.abstr act 约60%的人类T细胞急性淋巴细胞白血病(T-ALL)患者标本内能检测到致癌转录因子TAL1/SCL,但其致癌机制并不清楚。英国与新加坡科学家的一项研究揭示,TAL1通过活化miR-233阻断了FBXW7这一基因的表达,而FBXW7则是(T-ALL)中一个非常重要的肿瘤抑制基因。请参见 Jem官网:http://jem.rupress.org/content/210/8/1545.abstr act 8.BRCA1/Nrf2影响肿瘤发生的机制 8.BRCA1/Nrf2影响肿瘤发生的机制 安吉丽娜•朱莉因家族遗传BRCA1基因突变而预防性切除乳腺,使BRCA1成为了明星基因,而BRCA1引起癌症的机制却并不明确。研究发现BRCA1能够调控Nrf2依赖的抗氧化型号,即BRCA1的缺陷会使细胞氧化应激的敏感性增加,从而增加罹患多种肿瘤的风险。请参见 Jem官网:http://jem.rupress.org/content/210/8/1529. abstract 安吉丽娜•朱莉因家族遗传BRCA1基因突变而预防性切除乳腺,使BRCA1成为了明星基因,而BRCA1引起癌症的机制却并不明确。研究发现BRCA1能够调控Nrf2依赖的抗氧化型号,即BRCA1的缺陷会使细胞氧化应激的敏感性增加,从而增加罹患多种肿瘤的风险。请参见 Jem官网:http://jem.rupress.org/content/210/8/1529. abstract 9.趋化因子调控肿瘤细胞进入淋巴结 9.趋化因子调控肿瘤细胞进入淋巴结 淋巴道转移是肿瘤细胞转移的重要途径,而肿瘤细胞进入淋巴结的机制并不明确。最新一项研究发现淋巴窦血管内皮细胞表达的趋化因子CCL1在这一转移过程中发挥重要作用,通过与其受体CCR8的结合,CCL1-CCR8趋化了肿瘤细胞侵入淋巴结的过程。请参见 Jem官网:http://jem.rupress.org/content/210/8/1509.abstr act 淋巴道转移是肿瘤细胞转移的重要途径,而肿瘤细胞进入淋巴结的机制并不明确。最新一项研究发现淋巴窦血管内皮细胞表达的趋化因子CCL1在这一转移过程中发挥重要作用,通过与其受体CCR8的结合,CCL1-CCR8趋化了肿瘤细胞侵入淋巴结的过程。请参见 Jem官网:http://jem.rupress.org/content/210/8/1509.abstr act 10.孕酮的受体信号影响子宫内膜癌的激素治疗 10.孕酮的受体信号影响子宫内膜癌的激素治疗  在子宫内膜癌的治疗中,孕酮通过与其受体(PR)的结合发挥治疗作用,但由于缺少标志分子,其实际临床应用受到机制。UCLA的科学家发现,细胞基质中的PR信号影响了肿瘤细胞对孕酮的敏感性,证明基质PR作是孕酮疗效的标志分子。请参见 Jem官网:http://cancerres.aacrjournals.org/content/73/1 5/4697.abstract 在子宫内膜癌的治疗中,孕酮通过与其受体(PR)的结合发挥治疗作用,但由于缺少标志分子,其实际临床应用受到机制。UCLA的科学家发现,细胞基质中的PR信号影响了肿瘤细胞对孕酮的敏感性,证明基质PR作是孕酮疗效的标志分子。请参见 Jem官网:http://cancerres.aacrjournals.org/content/73/1 5/4697.abstract 11.基因修饰解决骨髓移槙的矛盾 11.基因修饰解决骨髓移槙的矛盾 在骨髓移植中,需要输入T细胞以抑制移植物抗宿主(GVHD)排斥,但这种抑制又会影响移植物抗肿瘤(GVT)活性,从而可能引起肿瘤复发。而最新一项研究发现锌指蛋白PLZF修饰的T细胞,即能抑制GVHD又保存了GVT的完整性,从而彻底解决了这一矛盾。请参见 Jem官网:http://cancerres.aacrjournals.org/content/73/15/4 687.abstract 在骨髓移植中,需要输入T细胞以抑制移植物抗宿主(GVHD)排斥,但这种抑制又会影响移植物抗肿瘤(GVT)活性,从而可能引起肿瘤复发。而最新一项研究发现锌指蛋白PLZF修饰的T细胞,即能抑制GVHD又保存了GVT的完整性,从而彻底解决了这一矛盾。请参见 Jem官网:http://cancerres.aacrjournals.org/content/73/15/4 687.abstract 12.卡妥索单抗的免疫调节作用卡妥索单抗(CatmAb)是一种抗CD3和上皮细胞粘附分子(EPCAM)的双特异性抗体,用于治疗EPCAM阳性肿瘤的恶性腹水。法国一项工作发现,CatmAb能提升CD4 T和CD8 T细胞分泌IFN-γ的能力,并在与奥沙利铂联合使用时促进肿瘤细胞的死亡。请参见 Jem官网: http://cancerres.aacrjournals.org/content/73/15/4663.abstract 13.IL-18的抗肿瘤作用机制美国一项研究发现细胞因子IL-18能够活化自然杀伤细胞(NK)并使其表出现一种"辅助性"功能——帮助DC细胞激活并招募/活化具有抗肿瘤作用的CD8效应性T细胞。这条"IL-18→NK细胞→DC→CD8效应T细胞"的通路揭示了IL-18抗肿瘤功能的内在机制。请参见 Jem官网: http://cancerres.aacrjournals.org/content/73/15/4653.abstract 12.卡妥索单抗的免疫调节作用卡妥索单抗(CatmAb)是一种抗CD3和上皮细胞粘附分子(EPCAM)的双特异性抗体,用于治疗EPCAM阳性肿瘤的恶性腹水。法国一项工作发现,CatmAb能提升CD4 T和CD8 T细胞分泌IFN-γ的能力,并在与奥沙利铂联合使用时促进肿瘤细胞的死亡。请参见 Jem官网: http://cancerres.aacrjournals.org/content/73/15/4663.abstract 13.IL-18的抗肿瘤作用机制美国一项研究发现细胞因子IL-18能够活化自然杀伤细胞(NK)并使其表出现一种"辅助性"功能——帮助DC细胞激活并招募/活化具有抗肿瘤作用的CD8效应性T细胞。这条"IL-18→NK细胞→DC→CD8效应T细胞"的通路揭示了IL-18抗肿瘤功能的内在机制。请参见 Jem官网: http://cancerres.aacrjournals.org/content/73/15/4653.abstract 14.阻断VEGF-C/D的抑制皮肤癌症的发生 14.阻断VEGF-C/D的抑制皮肤癌症的发生 淋巴管生长因子VEGF-C/D在肿瘤晚期能够促进肿瘤的转移,但其在早期的致癌作用一直未被证实。最新研究利用VEGF-C/D抑制剂阻断这两个因子,发现能明显抑制小鼠皮肤炎症引起的癌化,证明VEGF-C/D在肿瘤发生阶段就具有诱发癌症的功能。请参见 Jem官网:http://cancerres.aacrjournals.org/content/73/14/4212.abstract15.MMP-1协助肿瘤转移及机制 淋巴管生长因子VEGF-C/D在肿瘤晚期能够促进肿瘤的转移,但其在早期的致癌作用一直未被证实。最新研究利用VEGF-C/D抑制剂阻断这两个因子,发现能明显抑制小鼠皮肤炎症引起的癌化,证明VEGF-C/D在肿瘤发生阶段就具有诱发癌症的功能。请参见 Jem官网:http://cancerres.aacrjournals.org/content/73/14/4212.abstract15.MMP-1协助肿瘤转移及机制 局部肿瘤细胞渗透进入血液循环,是肿瘤转移重要的一个环节。研究发现胶原溶解蛋白酶(MMP-1)能够协助肿瘤细胞渗透进入血管,深入的机制研究表明,这一功能是通过活化内皮细胞上的蛋白酶活化受体1(PAR1),从而增加了血管通透性来完成的。请参见 Jem官网:http://cancerres.aacrjournals.or g/content/73/14/4196.abstract 局部肿瘤细胞渗透进入血液循环,是肿瘤转移重要的一个环节。研究发现胶原溶解蛋白酶(MMP-1)能够协助肿瘤细胞渗透进入血管,深入的机制研究表明,这一功能是通过活化内皮细胞上的蛋白酶活化受体1(PAR1),从而增加了血管通透性来完成的。请参见 Jem官网:http://cancerres.aacrjournals.or g/content/73/14/4196.abstract 16.HDAC帮助肿瘤细胞逃避NK细胞杀伤B7受体家族成员B7-H6特异性表达于肿瘤细胞表面,通过结合其配体——NK细胞表面的活化分子NKp30激活NK细胞的肿瘤杀伤作用。最新一项研究发现组蛋白去乙酰化酶(HDAC)能够下调肿瘤细胞B7-H6的表达,从而协助肿瘤细胞逃避NK细胞的杀伤。请参见 Jem官网: http://bloodjournal.hematologylibrary.org/content/122/5/684.abstract 17.CX3CR1受体抑制单核细胞向外周的迁移在炎症发生时,趋化因子受体CCR2负责驱使骨髓中的Ly6C^high单核细胞向外周炎症部位迁移。而研究发现另一受体CX3CR1发挥了完全相反的作用——负责抑制这种迁移,而这一功能在某些情况下,例如化疗后骨髓的恢复阶段具有重要的意义。请参见 Jem官网: http://bloodjournal.hematologylibrary.org/content/122/5/674.abstract 18.ASB2α调控DC细胞迁移肌动蛋白绑定的细丝蛋白(FLNs)是细胞骨架的主要组分之一,调控细胞骨架的弹性和刚度,并与细胞外环境连接。最新研究发现E3泛素化连接酶亚基ASB2α能够调控成熟DC细胞的运动,其机制正是由于ASB2α以FLNs为底物产生反应,从而间接调控DC细胞迁移。请参见 Jem官网: http://bloodjournal.hematologylibrary.org/content/122/4/533.abstract19.辅助性CD8 T细胞的发现按照经典免疫学理论,αβ T细胞分辅助性CD4 T/杀伤性CD8 T细胞,而德国科学家发现一群CD8 T细胞表达CD40L分子(辅助性CD4 T细胞的重要标志),并证实这些CD8 T细胞具有辅助功能——如活化APC及分泌细胞因子,这一发现打破了经典的免疫学框架。请参见 Jem官网: http://bloodjournal.hematologylibrary.org/content/122/3/405.abstract 16.HDAC帮助肿瘤细胞逃避NK细胞杀伤B7受体家族成员B7-H6特异性表达于肿瘤细胞表面,通过结合其配体——NK细胞表面的活化分子NKp30激活NK细胞的肿瘤杀伤作用。最新一项研究发现组蛋白去乙酰化酶(HDAC)能够下调肿瘤细胞B7-H6的表达,从而协助肿瘤细胞逃避NK细胞的杀伤。请参见 Jem官网: http://bloodjournal.hematologylibrary.org/content/122/5/684.abstract 17.CX3CR1受体抑制单核细胞向外周的迁移在炎症发生时,趋化因子受体CCR2负责驱使骨髓中的Ly6C^high单核细胞向外周炎症部位迁移。而研究发现另一受体CX3CR1发挥了完全相反的作用——负责抑制这种迁移,而这一功能在某些情况下,例如化疗后骨髓的恢复阶段具有重要的意义。请参见 Jem官网: http://bloodjournal.hematologylibrary.org/content/122/5/674.abstract 18.ASB2α调控DC细胞迁移肌动蛋白绑定的细丝蛋白(FLNs)是细胞骨架的主要组分之一,调控细胞骨架的弹性和刚度,并与细胞外环境连接。最新研究发现E3泛素化连接酶亚基ASB2α能够调控成熟DC细胞的运动,其机制正是由于ASB2α以FLNs为底物产生反应,从而间接调控DC细胞迁移。请参见 Jem官网: http://bloodjournal.hematologylibrary.org/content/122/4/533.abstract19.辅助性CD8 T细胞的发现按照经典免疫学理论,αβ T细胞分辅助性CD4 T/杀伤性CD8 T细胞,而德国科学家发现一群CD8 T细胞表达CD40L分子(辅助性CD4 T细胞的重要标志),并证实这些CD8 T细胞具有辅助功能——如活化APC及分泌细胞因子,这一发现打破了经典的免疫学框架。请参见 Jem官网: http://bloodjournal.hematologylibrary.org/content/122/3/405.abstract |