文章目录[隐藏]
通常所说的Th17是指在各种生理与病理条件下有能力分化为Th17的辅助性T细胞 (严格意义上是Th0)。当受到外界因素(如刺激素、病原体等)刺激,Th0即会向Th1、Th2、Th17等Th细胞分化。此时,通过检测分泌的细胞因子(如IFN-γ、IL-4、IL-17等)实现对各类Th细胞的检测。Th17主要分泌IL-17、IL-22等促炎因子,介导自身免疫性疾病和炎症反应。
静息状态下Th0分化为Th1、Th2、Th17等的能力非常弱,且流式细胞仪无法检测分泌到细胞外的细胞因子。因此,检测Th细胞时需要添加刺激剂及阻断剂。
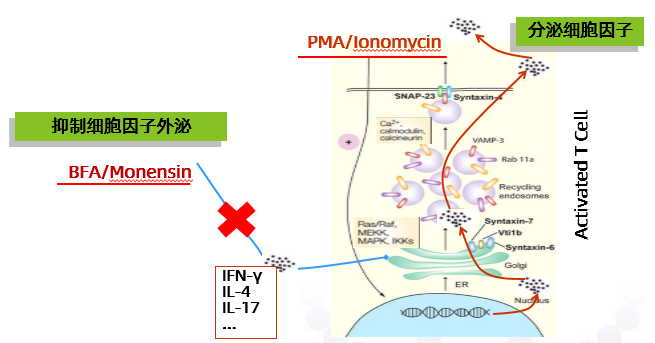
通常使用的刺激剂为PMA(佛波酯)+Ionomycin(离子霉素),也可使用CD3/CD28协同刺激、PHA刺激等来活化T细胞。实验表明,PMA为广谱刺激剂,即T细胞中的各亚群均会被PMA同等激活,而CD3/CD28协同刺激和PHA刺激,则是通过TCR受体的作用,仅对部分T细胞亚群有效。所以可根据实验的设计来选择刺激方式。通常选用的阻断剂为Brefeldin A (BFA, 布雷非德菌素 A)和/或Monensin (莫能霉素),通过破坏高尔基体来切断细胞因子的转运途径,干扰其分泌。
另外,实验过程中涉及到如何正确的选定Th(即辅助性T细胞)的问题。Th细胞的表面标志为CD3+CD4+,而当用PMA刺激4小时时,会发现CD4+的细胞明显减少,甚至消失,这是因为PMA会诱发细胞表面CD4分子被内吞。所以通常的做法是用CD3和CD8反设CD4细胞,即CD3+CD8-的细胞被认为是CD3+CD4+的细胞。(注:PMA对小鼠CD4的影响很小,所以检测小鼠Th17时可用CD4直接设门)。
Th17检测步骤
样本制备
全血标本:
用肝素抗凝管采集静脉血(必须用肝素钠抗凝,不可用肝素锂、EDTA或枸橼酸钠)1-2ml,血液室温或4℃放置,8小时内必须进行检测,否则需弃用。
外周血单个核细胞(PBMC)标本:
1. 对于使用其它抗凝剂(如EDTA或枸橼酸钠)抗凝血,采集静脉血至少1ml,采集后4小时内使用;
2. 加入等体积的Hank’s液或不含Ca2+和Mg2+的PBS或生理盐水稀释血液;
3. 取1ml淋巴细胞分离液加入离心管中;
4. 将稀释血液小心地加到淋巴细胞分层液上,注意保持两者界面清晰;
5. 室温下,1500r/min,离心15分钟;
6. 用毛细吸管轻轻吸出单个核细胞层,加入含有4-5ml Hank’s液或不含Ca2+和Mg2+的PBS或生理盐水的试管中,充分混匀;
7. 1500r/min,离心10分钟,弃上清后,再洗一次;
8. 弃上清,用含10%胎牛血清的培养基重悬单个核细胞,用台酚兰染色计数活细胞数(应在95%以上);
9. 调节细胞浓度为1x107/ml。
刺激效果检测(选做)
1、 全血标本:取125μl抗凝血至流式管中,加入125μl不含血清的培养基稀释到250μl;PBMC标本:用含10%胎牛血清的培养基重悬单个核细胞,用台酚兰染色计数活细胞数(应在95%以上);调节细胞浓度为1×107/ml,取250μl;
2、在标本中加入1μl 250×PMA/Ionomycin,混匀;
3、37℃,5% CO2培养箱培养4-6小时,期间注意相隔1-2小时混匀一次;
4、取100μl样本,加入Human CD3(或 Mouse CD4)和CD69PE(用量详见说明书),室温孵育20分钟(全血样本溶血)后,用流式染色缓冲液洗一遍,300g离心5分钟,弃上清,用流式染色缓冲液重悬至500μl,上机检测;
5、CD3+(或CD4+)细胞中,CD69的阳性率应达到90%以上,进行下一步正式实验。
正式试验
全血标本:取125μl抗凝血至流式管中,加入125μl不含血清的培养基和1μl PMA/Ionomycin Mixture(250×)和1μl BFA/Monensin Mixture(250×)。取125μl抗凝血和125μl不含血清的培养基,作为对照。混匀,37℃孵育4-6小时,每隔1-2小时取出震荡混匀;
PBMC标本:用含10%胎牛血清的培养基重悬单个核细胞,使细胞浓度为1×107/ml。取250μl PBMCs至流式管中,加入1μl PMA/Ionomycin Mixture (250×)和1μl BFA/Monensin Mixture (250×)。以只含PBMCs的样本作为对照。混匀,37℃孵育4-6小时,每隔1-2小时取出震荡混匀;
注:PMA/Ionomycin Mixture (250×)和 BFA/Monensin Mixture (250×)极易挥发,使用后请及时旋紧管盖。
2. 从样本管和对照管中取100μl细胞悬液至新的流式管中,加入5μl Anti-Human CD3, FITC 和5μl Anti-Human CD8α, PerCP-Cy5.5(或加入5μl Anti-Mouse CD3ε, FITC 和5μl Anti-Mouse CD4, PerCP-Cy5.5)。震荡混匀,室温避光孵育15分钟;
3. 每管加入100μl FIX & PERM Medium A,震荡混匀,室温避光孵育15分钟;
4. 用蒸馏水将10×Flow Cytometry Staining Buffer稀释为1×,每管加入2ml预冷1×Flow Cytometry Staining Buffer,300×g离心5分钟,弃上清;
注:液体尽量倒干净,不要有残留。
5. 每管加入100μl FIX & PERM Medium B和5μl Anti-Human IL-17A, PE(或5μl Anti-Mouse IL-17A, PE)。震荡混匀,室温避光孵育15分钟;
6. 每管加入2ml 1×Flow Cytometry Staining Buffer,300×g离心5分钟,弃上清;
7. 每管加入500μl 1×Flow Cytometry Staining Buffer 重悬,上机检测;或者加入500μl 1-4 %多聚甲醛重悬,2-8℃避光,于24小时内检测。
结果示例
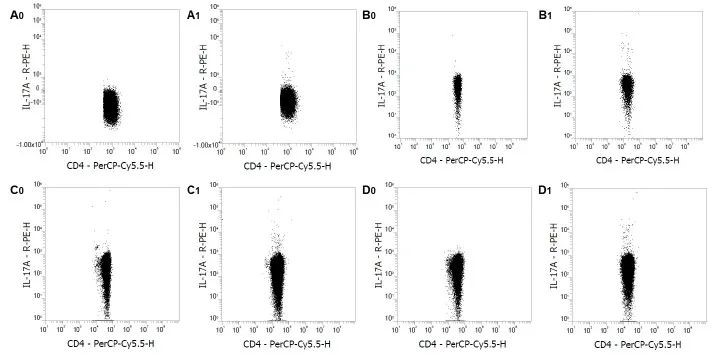
使用Mouse Th17 Staining Kit进行流式检测。正常ICR小鼠的静息肝素抗凝血(A0)、EDTA抗凝血来源的PBMCs (B0)、脾细胞(C0)和脾单个核细胞(D0)染色IL-17A。正常ICR小鼠的 PMA/Ionomycin刺激的肝素抗凝血(A1)、EDTA 抗凝血来源的 PBMC(B1) 脾细胞(C1)和脾单个核细胞(D1)染色IL-17A。对CD3+/CD4+细胞进行设门分析。
相关产品
-


- KTH001 2 Citations
- Th/Treg分型检测试剂盒
Human Th1/Th2/Th17 Staining Kit 人Th1/Th2/Th17染色试剂盒
- ¥3,200.00 – ¥12,000.00
-


- KTH117 3 Citations
- Th/Treg分型检测试剂盒
Human Th17 Staining Kit 人 Th17 染色试剂盒
- ¥2,680.00 – ¥10,050.00
-


- KTH217 19 Citations
- Th/Treg分型检测试剂盒
Mouse Th17 Staining Kit 小鼠辅助性Th17细胞检测试剂盒
- ¥1,940.00 – ¥7,290.00