http://www.liankebio.com/article-information_Tech-3159.html
作者:池博专刊 发布日期:2021-04-25 09:00
|
转化生长因子TGF-β的名称来源于其转化活性,根据不同的细胞系,当与EGF一起施用或不需要添加EGF时,可诱导细胞锚定非依赖性生长。最先被鉴定并分离的两种转化生长因子是TGF-α和-β(β1)。但是TGF-α属于EGF家族,与EGF受体结合,而TGF-β在结构上与TGF-α不同。当时区分这两种细胞因子的最显著特征是,TGF-β是一种25kD的二硫键链接的二聚体,经还原剂(例如β-巯基乙醇)处理后,在凝胶上还原为12.5kD的条带,而TGF-α是一种较小的单体蛋白。所以,TGF-α虽然以TGF命名,与TGF-β亲缘关系略远,属于EGF家族。
TGF-β1/β2/β3/β4/β5是TGF超家族下的一个分支(图1)。成熟的蛋白质在序列上高度保守,并有9个半胱氨酸残基。TGF-β2的三维结构显示,四个半胱氨酸对在分子内形成,但第六个半胱氨酸形成一个分子间二硫键,导致二聚体的形成。在哺乳动物有TGF-β1、TGF-β2、TGF-β3及TGF-β1β2四个亚型。在鸟类和两栖类动物还分别存在着TGF-β4和TGF-β5。 一、人类TGF-β1/β2/β3位于不同的染色体上,具不同的时空表达特点
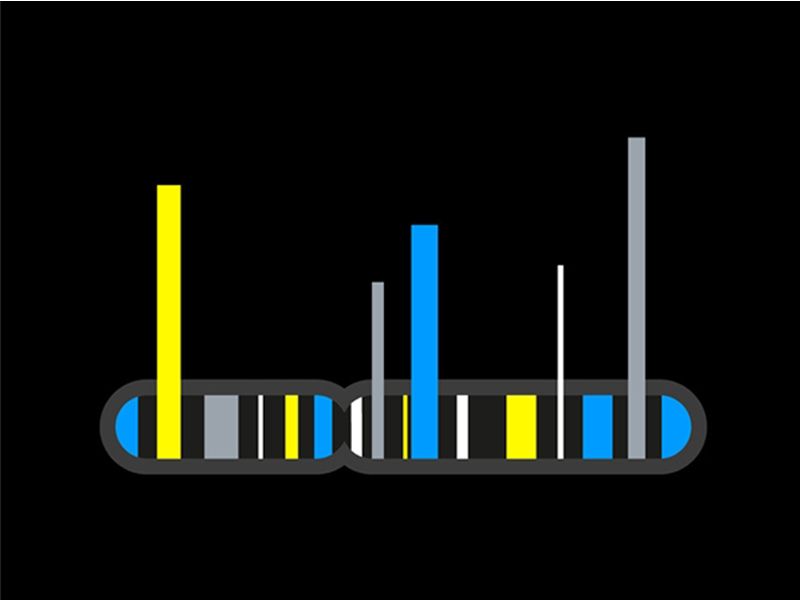
在人类3种TGF-β中,TGF-β1在多种组织中的表达都高于其他两个。特别是TGF-β2,在多数组织中表达水平都很低(图2)。 TGF-β1/β2/β3结合的I型受体有:ALK4/5/7,II型受体TGFBRII。可溶性配体首先与组成性活性TBRII结合,然后与TBRI富含甘氨酸/丝氨酸的结构域相互作用和磷酸化,产生活化的配体–受体复合物。然后,激活的TBRI使下游效应器Smad磷酸化。I型和II型激酶受体本身在酪氨酸和丝氨酸/苏氨酸残基处磷酸化,可能与多种信号转导途径的串扰活性调节有关。 TGF-β激酶受体的活性可由辅助TBRIII调节。Endoglin和Betaglycan是I型完整膜蛋白,具有大的胞外区和短的胞质区,缺乏激酶信号基序。Betaglycan普遍存在,与TGF-β1、TGF-β2、TGF-β3等亲和力高。Betaglycan增加配体与相应同源TBRIs和TBRIIs的结合,以调节其信号传导。Endoglin主要在血管内皮细胞中表达,血管内皮细胞是一种很少或没有Betaglycan表达的细胞类型。Endoglin与TGF-β1相互作用,需要存在相应的信号受体;而可以独立于激酶受体直接与TGF-β3结合。Endoglin增强TGF-β1依赖性Smad1/Smad5反应,同时抑制TGF-β/Smad3途径。 三、TGF-β1/β2/β3的功能 TGF对细胞增殖具有调控作用。“TGF-β家族”的名称来源于创始成员TGF-β1在初始转化试验中的活性。然而,这个名字可能有点误导。三种TGF-β亚型在发育和成体生物体中调节多种细胞过程,其作用依赖于环境。这三种TGF-β亚型已被确定为最有效的生长抑制剂,并可抑制大多数类型细胞的增殖。不仅不同类型的细胞对TGF-β的反应不同,而且同一类型的细胞在不同的实验条件下也可能表现出相反的反应。与抑制增殖的分子机制相比,诱导增殖的分子机制尚不明确。在某些情况下,促生长作用似乎次于其他细胞因子的诱导,如PDGF。 TGF-β蛋白调控细胞分化和干细胞。TGF-β家族成员控制着多种细胞类型的发育、分化和功能。大约50%的TGF-β1基因敲除小鼠在子宫内死亡,其余小鼠在出生后死于不受控制的炎症。TGF-β2缺陷小鼠在多个器官中表现出缺陷,包括心脏、肺、颅面、肢体、脊髓、眼睛、内耳和泌尿生殖道。TGF-β3缺陷小鼠在肺和腭发育过程中表现出缺陷,表明其在EMT中的关键作用。此外,缺乏TGF-β2和-β3表达的小鼠显示出中枢神经系统的缺陷。 TGF-β在癌症干细胞和癌症进展中发挥作用。TGF-β/激活素信号在维持某些癌症始发细胞群的干细胞样特性方面起着重要作用,例如胶质瘤始发细胞、乳腺癌干细胞、胰腺癌始发细胞,以及慢性髓系白血病中的白血病起始细胞。与这些观察结果一致,在一些动物模型中,对TGF-β/激活素I型受体激酶的药理学抑制可减少癌症进展。另一方面,TGF-β在某些癌症(包括乳腺癌、胰腺癌和弥漫型胃癌)中也显示出减少癌症起始细胞群的作用。 TGF-β 控制伤口愈合。TGF-β1通过对多种细胞类型的作用来调节伤口愈合过程的不同步骤,强烈促进体内伤口愈合。 结缔组织和骨骼疾病中TGF-β的异常激活。导致主动脉瘤的临床重叠情况,例如Loeys–Dietz综合征、家族性胸主动脉瘤和夹层以及动脉瘤-骨关节炎综合征,也由TGF-β信号增强引起。 GF-β信号转导增加导致纤维化。当皮下注射纯化的TGF-β1,在注射部位可诱导纤维化病变。TGF-β/Smad3信号的失调和持续激活在纤维化组织表型的启动和维持中起着重要作用。 尽管TGF-β1、-β2和-β3通过相同的受体和Smad2/3途径发挥作用,但在功能方面存在差异,这一方面原因在于3种细胞因子时空表达不同,另一方面在于与受体亲和力不同,例如TGF-β1对TBRI和TBRII的亲和力都较TGF-β2的大10-80倍。此外,在伤口愈合的控制方面存在差异,有待充分解释。给予TGF-β1或-β2可促进伤口愈合早期的ECM沉积,但用TGF-β1或-β2治疗的伤口在瘢痕形成的最终质量上与对照伤口没有区别。然而,抑制TGF-β/Smad3信号,例如在Smad3表达缺失或存在TGF-β1和-β2抗体的情况下,可提高伤口愈合质量并减少疤痕。此外,TGF-β3(而非TGF-β1或TGF-β2)的施用也可减少皮肤瘢痕形成。因此,重组TGF-β3可被认为促进无瘢痕伤口愈合。 鉴于以上所提及的重要作用,TGF-β一直是研究热点。目前我们已经开发Human/Mouse/Rat TGF-β1和TGF-β2的ELISA Kit。欢迎垂询! 主要摘自: ● Morikawa M, Derynck R, Miyazono K. TGF-beta and the TGF-beta Family: Context-Dependent Roles in Cell and Tissue Physiology. Cold Spring Harb Perspect Biol. 2016; 8(5):a021873. ● Santibañez JF, Quintanilla M, Bernabeu C. TGF-beta/TGF-beta receptor system and its role in physiological and pathological conditions. Clin Sci (Lond). 2011;121(6):233-51. |


 图2. 人类不同组织TGF-β1/β2/β3的表达水平(数据来自于NCBI)
图2. 人类不同组织TGF-β1/β2/β3的表达水平(数据来自于NCBI)