http://www.liankebio.com/article-information_Dynamic-2202.html
作者:佚名 发布日期:2017-11-09 09:00
|
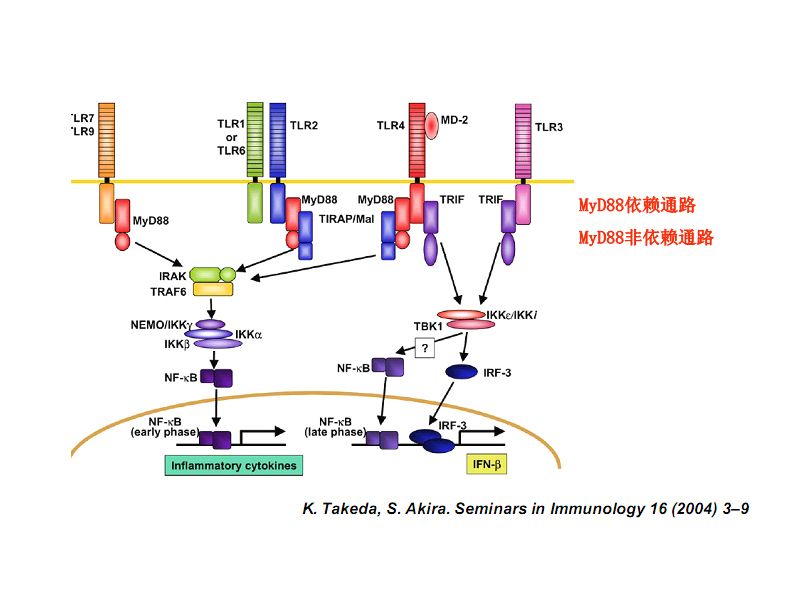
近日,中国科学院上海生命科学研究院神经科学研究所、脑科学与智能技术卓越创新中心、神经科学国家重点实验室熊志奇研究组,在小脑和运动障碍研究领域取得进展。相关研究成果以《PRRT2缺失造成小脑内的突触传递异常介导阵发性运动诱发性运动障碍》为题,在线发表在Cell Research上。研究人员系统地从分子、突触、细胞和神经环路水平解析了阵发性运动诱发性运动障碍(Paraxysmalkinesigenic dyskinesia, PKD)致病基因PRRT2在脑内的神经生物学作用及机制,为理解发作性运动障碍的发病机理和神经元突触囊泡转运的分子调控机制提供了新的认识。 PKD是严重的中枢神经系统疾病,表现为非自愿性运动所诱发的肌张力障碍、舞蹈病、手足徐动症、颤搐或这些运动失调症状的组合,发作时没有意识丧失,多发于青少年时期。该病自1967年被Kertesz等详细描述以来,其确切的发病机制一直不明。熊志奇研究组此前与复旦大学华山医院教授吴志英、福建医科大学教授王柠课题组合作,发现了PKD首个致病基因PRRT2。作为第一个被鉴定出来的PKD致病基因,PRRT2在体内的生物学功能以及如何调控运动功能,是亟待研究解决的问题。 在该研究工作中,研究人员发现PRRT2是一个新的突触蛋白,可与突触蛋白Syntaxin1A及SNAP25相互作用,影响神经元突触内SNARE蛋白复合体的形成,从而调控囊泡入坞到突触前膜的过程。尽管关于细胞囊泡运输和调控机制的研究已相对完善且非常重要,但人们从未发现该分子的调控作用,该研究揭示了突触囊泡转运上膜过程中的一个新“车闸”。研究人员制备了一系列的PRRT2基因突变小鼠,涵盖模拟病人体内突变位点、脑内选择性基因敲除、病毒介导的小脑内局部基因敲除、小脑颗粒细胞内选择性基因敲除等方式,发现当PRRT2在体内的功能缺失后,小鼠会在癫痫发作后、高温环境下以及光遗传刺激小脑的情况下出现阵发性运动失调和肌张力障碍等症状,表型与病人的症状十分相像。该症状的严重程度同蛋白表达量负相关,并可被抗癫痫药卡马西平所改善。研究人员使用Ai32、GluN2C-iCre、Prrt2-floxed等三种转基因鼠,制备出可在小脑内颗粒细胞中特异地自表达光遗传通道蛋白CHR2而同时选择性地敲除PRRT2基因的小鼠,进行全细胞电生理记录发现,PRRT2突变小脑内颗粒细胞的平行纤维与浦肯野细胞之间的突触传递改变,造成浦肯野细胞放电异常,导致小脑功能紊乱和阵发性运动障碍。多年来,PKD研究中存在的条件限制是缺乏有效的动物模型,该研究首次制备了小鼠PKD模型,利用多种物理或化学范式,为后续开展药物开发或干预治疗探索提供了稳定可靠的动物疾病模型。综上所述,该研究详细而系统地揭示了PRRT2在脑内的表达和功能,首次在体确认了PKD发病的PRRT2功能缺失机制,揭示了PRRT2在突触SNARE复合体形成和囊泡释放中的重要调节作用,确定了小脑尤其是小脑颗粒细胞在PKD发病过程中的核心作用,解决了一直困扰该研究领域的关于PKD关键调控脑区环路的争论,推进了人们对发作性运动障碍发病机制的认识,同时对人们理解突触传递的最新分子调控机制也很有启发。 该研究工作得到了科技部项目、中国科学院战略性先导科技专项、国家自然科学基金和上海市科委等的资助。
|