文章目录[隐藏]
肿瘤相关巨噬细胞(Tumor associated macrophages,TAMs)是肿瘤中最丰富的免疫细胞群,其主要有两种极化状态,促肿瘤M2型和抑制肿瘤M1型。M2肿瘤相关巨噬细胞(M2-TAMs)在肿瘤发生、发展和转移中发挥着重要作用,而将M2-TAMs再极化为M1型被认为是临床上治疗顽固性肿瘤的一种前景可观的策略。目前再极化M2细胞的技术还不成熟,其中如何克服肿瘤低氧特性是个难点。
近日,浙江大学药学院在著名期刊ACS NANO上发表了题为:Dual Inhibition of Endoplasmic Reticulum Stress and Oxidation Stress Manipulates the Polarization of Macrophages under Hypoxia to Sensitize Immunotherapy的研究论文(IF=15.881,材料科学1区)。

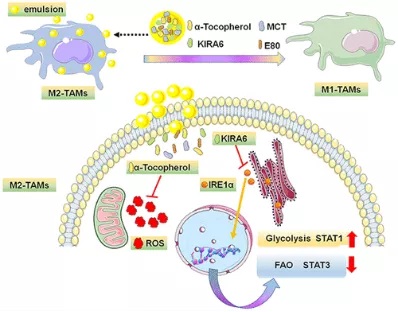
在该研究中,浙江大学团队构建了含有KIRA6 (内质网应激抑制剂)和α-生育酚(氧化应激抑制剂)的纳米乳剂α-T-K。发现同时抑制内质网应激和氧化应激可以有效地使M2-TAMs在缺氧条件下复极化,从而抑制4T1乳腺癌的生长,有效加强PD-1抗体(aPD1) 在Lewis肺癌中的治疗效果。这不仅填补了目前在调控缺氧条件下巨噬细胞生物复极化方面的空白,而且为增敏抗PD-1的临床免疫治疗提供了有意义的参考。
实验方法和结论
首先,将内质网应激抑制剂KIRA6封装到含有α-生育酚(ROS抑制剂)的纳米乳中,以含有单一抑制剂(α-T和K)的纳米乳剂作为对照。
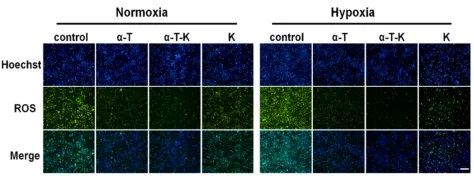
实验结果显示:所制备的纳米颗粒在4℃下稳定性极佳,粒径约为100 nm;在缺氧和常态条件下均易被巨噬细胞内化,且无明显细胞毒性;在常态和缺氧条件下,α-T和α-T- k均可显著降低RAW264.7细胞的活性氧水平。
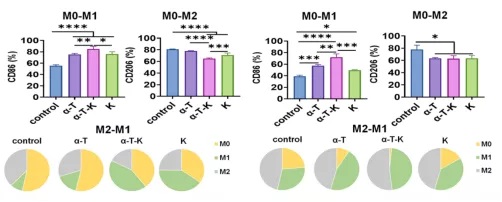
进一步的体外实验表明,所有纳米乳剂,特别是α-T-K,都能引导M0和M2细胞分化。乳剂可使M0分化更倾向于M1表型,且它们的能力不受缺氧环境的限制。同样,α-T-K能有效地诱导M2 - bmdm向M1表型的复极化。结果表明,纳米颗粒处理的巨噬细胞促进了淋巴细胞的增殖,同时抑制癌细胞的生长。
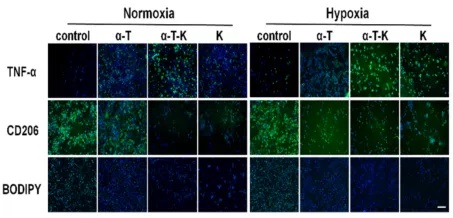
M1和M2细胞的代谢是不同的。M2细胞更依赖于氧化磷酸化(OXPHOS)和脂肪酸氧化(FAO)提供能量,这表明,改变细胞代谢可能是调节巨噬细胞分化的良好靶点。研究团队分析该纳米乳剂处理后的巨噬细胞蛋白表达发现纳米乳剂的干预增加了巨噬细胞中TNF-α和乳酸的表达,限制了CD206的表达和细胞内脂滴的积聚,这意味着同时抑制内质网应激和氧化应激使巨噬细胞的代谢从脂肪酸代谢转向糖酵解。细胞代谢的变化进一步导致转录因子发生相应变化,最终实现M2细胞的重编程。
接下来,研究团队建立4T1乳腺癌模型,验证纳米乳剂在体内的作用。
实验数据显示,α-TK有效降低了XBP1的表达,使M2细胞重极化为M1表型,延缓了肿瘤的生长。为了进一步探索该纳米乳剂在肿瘤抗PD-1免疫治疗中的作用,他们选采用巨噬细胞丰富的小鼠Lewis肺癌作为肿瘤模型。结果显示,纳米乳液在体内和体外均表现出强烈的诱导M2-TAMs复极化的作用。
考虑到M2巨噬细胞在肿瘤治疗中的阻碍作用,研究团队继续探索该纳米乳剂在肿瘤抗PD-1免疫治疗中的作用。
结果显示:α-T-K显著增强了PD-1抗体抗肿瘤作用;联合用药组患者外周血、脾脏、淋巴结及肿瘤组织中CD4+、CD8+及CD8+CD44+ T细胞数量显著增加,尤其是肿瘤组织中;α-T-K + aPD1组M1/M2比例最大,且M1相关细胞因子(IL-12、TNF-α、iNOS)最多,M2相关细胞因子(IL-10、TGF-β、Arg1)最少。
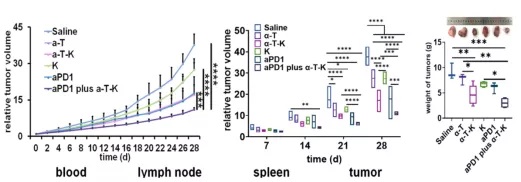
研究团队同时使用IRE1-XBP1抑制剂和ROS,体外和体内实验均表明,内质网应激和氧化应激的双重抑制通过诱导巨噬细胞从脂肪酸氧化向糖酵解的代谢转移,成功地调控了M2-TAMs的复极化。构建的α-T-K不仅延缓了肿瘤的恶化,而且大大提高了PD-1抗体的治疗效果。该研究将内质网应激与巨噬细胞极化紧密联系在一起,为缺氧条件下M2-TAMs的有效重编程提供了一种有效途径。
联科生物Multisciences提供的ELISA检测试剂盒助力该团队高效地完成了实验。祝贺该研究团队取得优异的科研成果,同时也希望我们联科生物的产品能服务于更多的生物医学科研团队。

联科生物提供的ELISA试剂盒种类多样,质控严格,具有多款试剂盒供您选择。更多信息请浏览官网或与我们联系。