胰导管腺癌(PDAC)是最致命的肿瘤类型之一,5年内患者的生存率低于10%。临床上,手术切除仅适用于小部分患者,更多采用化疗或放疗。然而,PDAC对这些传统疗法表现出固有的或获得性的耐药性。
免疫治疗,特别是免疫检查点阻断(ICB)治疗,最近已被用于PDAC治疗。然而,PDAC是一种典型的免疫排斥肿瘤,由于肿瘤免疫原性低和肿瘤内细胞毒性T淋巴细胞(CTL)浸润不足,ICB治疗对PDAC只是略有益处。
近年来,多项证据表明,超过90%的PDAC肿瘤显示细胞内活性氧(ROS)积累增加。PDAC肿瘤细胞强烈依赖内源性还原剂(如谷胱甘肽(GSH))来解毒细胞内ROS并维持氧化还原稳态。因此,异常的氧化还原稳态可能是PDAC肿瘤的致命弱点。已有研究表明,肿瘤氧化还原平衡障碍和铁死亡协同诱导肿瘤细胞死亡可能是一种有前途的PDAC治疗方法。
来自中科院上海药物研究所的研究团队在《Small Methods》上发表了题为Redox Dyshomeostasis with Dual Stimuli-Activatable Dihydroartemisinin Nanoparticles to Potentiate Ferroptotic Therapy of Pancreatic Cancer 的文章。该团队证明了双氢青蒿素(DHA)和抑制剂RSL-3的组合可以使PDAC肿瘤细胞对铁死亡的敏感度上升;DHA偶联和RSL-3负载的纳米颗粒(PDBA@RSL-3 NPs) 联合程序性死亡配体1 (PD-L1)阻断疗法,增强了肿瘤的免疫治疗效果。

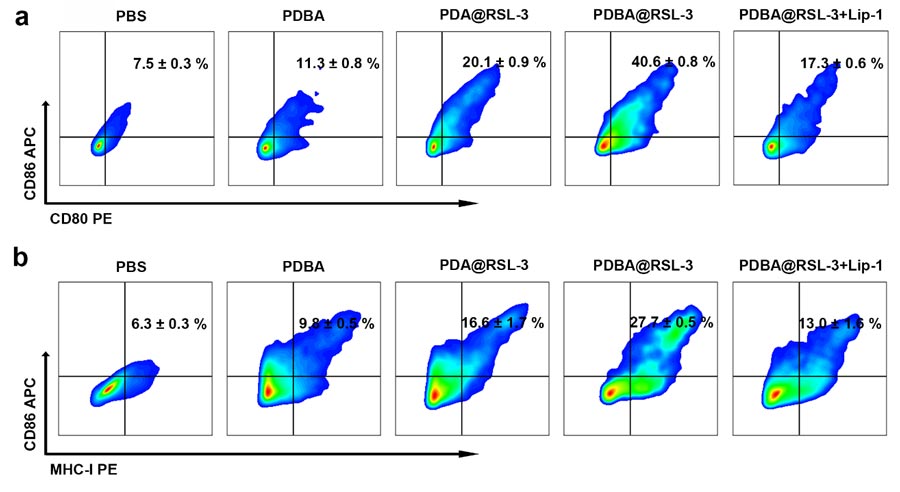
该团队设计了肿瘤穿透性强、可在肿瘤组织中高度扩散的PDBA@RSL-3 NPs。其中,纳米颗粒最大限度地提高了RSL-3的包封容量,并在肿瘤细胞内实现酸性环境/ ROS触发的药物释放。PDBA@RSL-3 NPs在体内特异性分布于Panc02免疫缺陷小鼠模型的肿瘤中,并显著诱导肿瘤细胞铁死亡。研究表明,PDBA@RSL-3 NPs有效地抑制了Panc02免疫缺陷小鼠模型中的肿瘤生长。另外,PDBA@RSL-3 NPs在具有免疫能力的小鼠模型中诱导了有效的抗肿瘤免疫,并促进了CTL的肿瘤部位浸润。PDBA@RSL-3 NPs与PD-L1阻断治疗的联合,通过绕过诱导性免疫抵抗和诱导免疫记忆效应,进一步提高了抗肿瘤性能。这种基于纳米药物的氧化还原平衡和铁死亡诱导策略可以为增强PDAC免疫治疗效果提供新的见解。总之,该团队报道了一种RSL-3和DHA双负载的PDBA@RSL-3 NPs,通过诱导PDAC肿瘤细胞的氧化还原平衡障碍和铁死亡来改善PDAC治疗。
MultiSciences 助力研究
流式抗体:

文章引用产品列表
-
- F21080A02 5 Citations
- 流式抗体
Anti-Mouse CD80, PE (Clone:009) 检测试剂
- ¥1,130.00 – ¥3,140.00
-
- F2108603 7 Citations
- 流式抗体
Anti-Mouse CD86 (B7-2), APC (Clone:GL-1) 流式抗体 (新品)
- ¥1,080.00 – ¥2,376.00
-
- F21011C01 9 Citations
- 流式抗体
Anti-Mouse CD11c, FITC (Clone:N418)流式抗体 (新品)
- ¥208.00 – ¥440.00