文章目录[隐藏]
铁死亡激活被认为是治疗癌症的有力武器,增强肿瘤细胞对铁死亡的敏感性越来越受到重视。然而,某些铁死亡抵抗机制长期以来受到忽视,特别是肿瘤细胞的异常代谢。
图1
2023年6月5日,山东大学药学院翟光喜教授、杨小叶副研究员在国际期刊ACS Nano(Q1区,IF=17.1)杂志上发表了题为“A Vanadium-Based Nanoplatform Synergizing Ferroptotic-like Therapy with Glucose Metabolism Intervention for Enhanced Cancer Cell Death and Antitumor Immunity”的研究性论文。
作者提出了一种通过调节肿瘤细胞糖代谢来增强铁死亡激活的模式,并构建了一种名为PMVL的纳米平台。
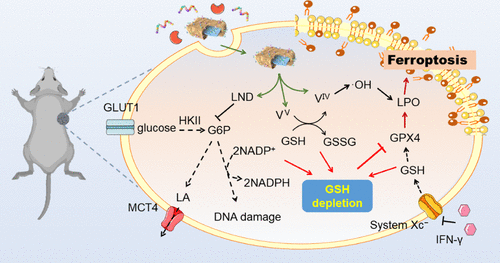
图2 本研究的示意图
该平台由负载氯尼达明(LND)的单宁酸与钒氧化物配位而成,并用PD-L1抑制肽修饰的肿瘤细胞膜包裹。
本研究表明,PMVL中钒具有混合价态(VIV和VV),由于V的自循环价态改变而引发铁死亡,这一过程产生•OH用于脂质过氧化积累(VIV→VV),并消耗谷胱甘肽(GSH)用于谷胱甘肽过氧化物酶(GPX4)失活(VV→VIV)。值得注意的是,LND通过抑制戊糖磷酸途径(减少NADPH产生)来增强铁死亡,抑制GSH合成。
此外,糖酵解抑制减少了胞内乳酸的产生,减轻了肿瘤微环境的酸性,抑制了免疫抑制性M2巨噬细胞极化。体外和体内结果表明糖代谢干预增强了肿瘤的铁死亡和免疫激活,显著提高了肿瘤的协同治疗效果。
联科生物产品助力科研
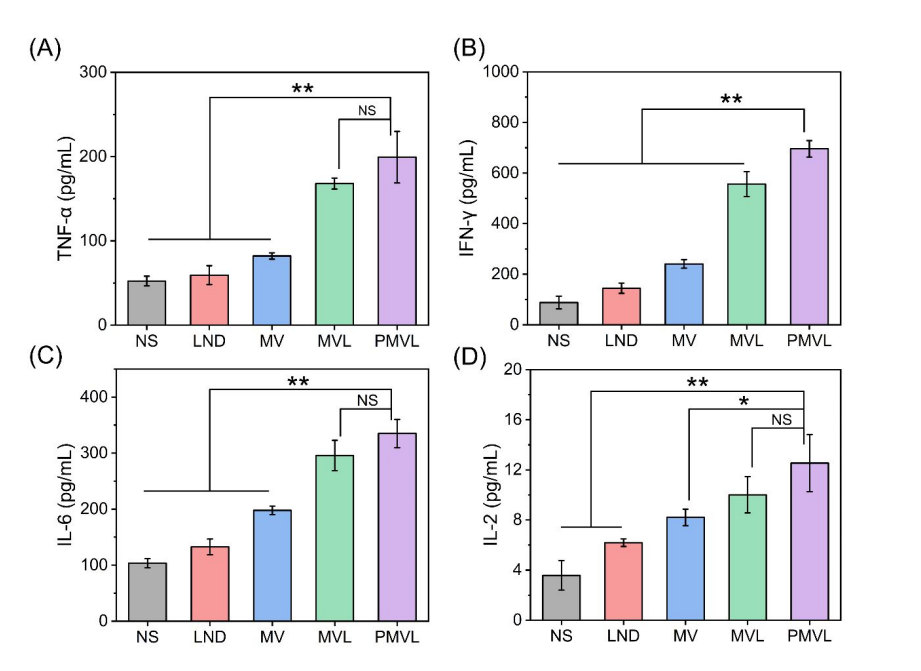
图3 TNF-α (A), IFN-γ (B), IL-6 (C) 和 IL-2 (D) 的浓度
这篇论文所使用的联科生物产品——Mouse TNF-α ELISA Kit、Mouse IFN-γ ELISA Kit、Mouse IL-6 ELISA Kit和Mouse IL-2 ELISA Kit,广泛应用于科研研究,基础医学,临床研究等领域,如细胞药物研究、免疫治疗领域、干细胞应用领域、肿瘤治疗及靶点药物研究、炎症或病毒感染治疗及预后研究。
参考文献:
Yu Zhang, Xiyou Du, Zhijing He, Shan Gao, Lei Ye, Jianbo Ji, Xiaoye Yang, and Guangxi Zhai. ACS Nano 2023 17 (12), 11537-11556. DOI: 10.1021/acsnano.3c01527.
原文链接:
http://pubs.acs.org/doi/10.1021/acsnano.3c01527
![]()
END