文章目录[隐藏]
- 检测原理
- 检测方法
- PMA/Ionomycin Mixture(250X)佛波酯/离子霉素混合物
- BFA/Monensin Mixture(250X) 布雷非德菌素A/莫能霉素混合物
- Flow Cytometry Staining Buffer流式染色缓冲液
- Fix & Perm Kit固定破膜剂
- Anti-Mouse CD3ε, FITC (Clone:145-2C11) 流式抗体 (新品)
- Anti-Mouse CD4, PerCP-Cy5.5 (Clone:GK1.5) 流式抗体 (新品)
- Anti-Mouse IFN-γ, PE (Clone:XMG1.2) 流式抗体 (新品)
- Anti-Mouse IL-4, APC (Clone:11B11)流式抗体 (新品)
- 【实验步骤】
- 其它相关细胞因子的检测

检测原理
小鼠Th1/Th2细胞与人的相似,均可分泌多种细胞因子:
- Th1 细胞主要分泌 IL-2、IL-12、IFN-γ和 TNF-β/α等
- Th2 细胞主要分泌 IL-4、IL-5、IL-6 和 IL-10
与人相同,鉴别 Th1/Th2同样采用下面的组合:
- Th1:CD4+IFN-γ+,
- Th2:CD4+IL-4+
刺激素也是我们通常选用的为PMA(佛波酯)+ Ionomycin(离子霉素)。
与人Th1/Th2不同的是,小鼠淋巴细胞在PMA和Ionomycin的刺激下,其表面的CD4 抗原下降不明显,因此可以用CD4的抗体直接设门分析Th1/Th2。
检测方法
【刺激阻断剂】
-


- CS1001 128 Citations
- 刺激阻断剂
PMA/Ionomycin Mixture(250X)佛波酯/离子霉素混合物
- ¥460.00 – ¥2,060.00
-


- CS1002 95 Citations
- 刺激阻断剂
BFA/Monensin Mixture(250X) 布雷非德菌素A/莫能霉素混合物
- ¥460.00 – ¥2,060.00
PMA/Ionomycin Mixture (250×) 和BFA/Monensin Mixture (250×) 极易挥发,使用后请及时旋紧管盖。
【破膜剂和流式染色缓冲液】
-


- S1001 24 Citations
- 流式染色缓冲液
Flow Cytometry Staining Buffer流式染色缓冲液
- ¥110.00
-


- GAS005 94 Citations
- 固定破膜剂
Fix & Perm Kit固定破膜剂
- ¥640.00 – ¥10,010.00
【抗体】
-
- F2100301 20 Citations
- 流式抗体
Anti-Mouse CD3ε, FITC (Clone:145-2C11) 流式抗体 (新品)
- ¥208.00 – ¥440.00
-
- F2100404 4 Citations
- 流式抗体
Anti-Mouse CD4, PerCP-Cy5.5 (Clone:GK1.5) 流式抗体 (新品)
- ¥600.00 – ¥1,320.00
-
- F21IFNG02 5 Citations
- 流式抗体
Anti-Mouse IFN-γ, PE (Clone:XMG1.2) 流式抗体 (新品)
- ¥440.00 – ¥968.00
-
- F21IL403 4 Citations
- 流式抗体
Anti-Mouse IL-4, APC (Clone:11B11)流式抗体 (新品)
- ¥1,112.00 – ¥2,464.00
【其他可能需要的产品】
| 供应商 | 产品名称 | 货号 | 规格 |
| MultiSciences | 小鼠淋巴细胞分离液 | MLSM1092 | 200ml |
| MultiSciences | 4% 多聚甲醛 | F0001 | 100ml |
| Thermo Fisher | 补偿调节微球 | 01-1111-41 | 25 tests |
【实验步骤】
(1).标本采集及制备
A. 血液标本
小鼠血液标本一般采用眼眶后静脉丛采血法,因此法不需麻醉或处死小鼠,对小鼠的伤害小,且可重复采血,具体方法如下:
• 1)穿刺采用一根特制的长7~10cm硬的玻璃取血管,其一端内径为1~1.5m,另一端逐渐扩大,细端长约1cm即可,将取血管浸入1%肝素溶液,干燥后使用;
• 2)采血时,左手拇指及食指抓住鼠两耳之间的皮肤使鼠固定,并轻轻压迫颈部两侧,阻碍静脉回流,使眼球充分外突,提示眼眶后静脉丛冲血;
• 3)右手持取血管,将其尖端插入内眼角与眼球之间,轻轻向眼底方向刺入,当感到有阻力时即停止刺入,旋转取血管以切开静脉丛,血液即流入取血管中;
• 4)采血结束后,拔出取血管,放松左手,出血即停止。
注:
• 1)用本法在短期内可重复采血。小鼠一次可采血 0.2~0.3ml;
• 2)为适用于 Th1/Th2检测,需用肝素钠来处理取血管,不可用肝素锂、EDTA 或枸橼酸钠。
B. 脾单细胞悬液的制备
脾单细胞悬液的制备通常有两种方法,可依据自己的喜好及习惯来选择。
• 1) 研磨法
Ø 小鼠用 CO2 处死,立即无菌取脾;
Ø 将脾浸入装有冷PBS的培养皿中,用钝头剪刀剪去白色的结缔组织,换入另一个装有冷 PBS的培养皿中以清洗脾脏;
Ø 再次换入一个装有冷PBS的培养皿中;
Ø 用小的弯头手术剪剪切脾脏成3mm3左右的小块;
Ø 用5ml或10ml塑料一次性注射器的尾部背面轻轻按压研磨脾脏小块,此时会看到很多脾单细胞进入PBS中。对于一只30克左右的小鼠,完全研磨脾脏后约可获得100 x 106 左右的细胞;
Ø 经200目筛网过滤获得单细胞悬液,用冷PBS洗涤2次,每次1000r/min, 离心10分钟;
Ø 将细胞悬浮于RPMI1640(含10%热灭活FBS)中,用台酚兰染色计数活细胞数(应在95%以上);
Ø 调节细胞浓度为2 x 106细胞/ml。
• 2) 穿刺法
Ø 小鼠用CO2处死,立即无菌取脾;
Ø 将脾浸入装有冷PBS的培养皿中,用钝头剪刀剪去白色的结缔组织,换入另一个装有冷 PBS的培养皿中以清洗脾脏;
Ø 用 10ml 注射器的针头在脾脏表面密密麻麻穿刺;
Ø 用针头吸取培养皿中的PBS,用力注入脾脏中,细胞即会从小孔中流出;
Ø 彻底冲出脾细胞内的细胞,用玻璃吸管吸取细胞悬液;
Ø 经200目筛网过滤获得单细胞悬液,用冷PBS洗涤2次,每次 1000r/min, 离心10分钟;
Ø 将细胞悬浮于RPMI1640(含 10%热灭活FBS)中,用台酚兰染色计数活细胞数(应在 95%以上);
Ø 调节细胞浓度为 2 x 106 细胞/ml。
C. 淋巴结单细胞悬液的制备
Ø 小鼠用 CO2 处死,立即无菌取出腋下和腹股沟淋巴结;
Ø 将淋巴结浸入装有冷 PBS 的培养皿中,用钝头剪刀剪去脂肪组织,换入另一个装有冷 PBS 的培养皿中以清洗脾脏;
Ø 再次换入一个装有冷 PBS 的培养皿中;
Ø 用小的手术剪剪切淋巴结成 3-4mm 大小的小块;
Ø 在培养皿中放置一个孔径为 20um 的筛网,用 5ml 或 10ml 塑料一次性注射器的尾部背面轻轻按压小块,使得淋巴结的单细胞通过筛网进入其下面的 PBS 液中;
Ø 用冷 PBS 洗涤 2 次,每次 1000r/min, 离心 10 分钟;
Ø 将细胞悬浮于 RPMI 1640(含 10%热灭活FBS)中,用台酚兰染色计数活细胞数(应在 95%以上);
Ø 调节细胞浓度为 2 x 106 细胞/ml。
(2).刺激及染色
• 1a. 对于肝素抗凝血,取125μl 抗凝血至流式管中,加入125μl不含血清的培养基和1μl PMA/Ionomycin Mixture (250×)和 1μl BFA/Monensin Mixture (250×)。取125μl 抗凝血和125μl不含血清的培养基,作为对照。混匀,37℃孵育 4 - 6 小时,每隔1 - 2小时取出震荡混匀。
注:肝素抗凝血样本也可选择方法 B 进行处理,在我们的试验结果中,比全血样本能检测到更多的细胞因子,原因未知。
• 1b. 对于使用其它抗凝剂 (如EDTA、枸橼酸钠)抗凝血,用淋巴细胞分离液 (Cat No: MLSM1092,MultiSicences) 分离外周血单个核细胞 (PBMCs)。用含10%胎牛血清的培养基重悬沉淀,使细胞浓度为1×107/ml。取250μlPBMCs 至流式管中,加1μl PMA/Ionomycin Mixture (250×) 和1μl BFA/Monensin Mixture (250×)。以只含 PBMCs 的样本作为对照。混匀,37℃孵育 4 - 6小时,每隔 1 - 2 小时取出震荡混匀。
• 1c. 对于脾脏组织,使用适当的方法制备成单细胞悬液,并去除团块。
(可选)使用淋巴细胞分离液 (Cat No: MLSM1092, MultiSicences) 分离制备脾单个核细胞。
用含10%胎牛血清的培养基重悬沉淀,使细胞浓度为 1 × 107/ml。取 250μl 细胞悬液至流式管中,加入1μl PMA/Ionomycin Mixture (250×)和1μl BFA/Monensin Mixture (250×)。以只含细胞悬液的样本作为对照。混匀,37℃孵育 4 - 6 小时,每隔 1 - 2 小时取出震荡混匀。
注:在我们的试验结果中,脾细胞经淋巴细胞分离液分离后能检测到更多的细胞因子,原因未知。
• 2.从样本管和对照管中取 100 μl 细胞悬液至新的流式管中,加入 5 μl Anti-Mouse CD3ε, FITC 和5 μl Anti-Mouse CD4, PerCP-Cy5.5。震荡混匀,室温避光孵育 15 分钟。
• 3.每管加入100 μl FIX & PERM Medium A,震荡混匀,室温避光孵育 15 分钟。
• 4.用蒸馏水将10×Flow Cytometry Staining Buffer稀释为1×,每管加入2 ml预冷1×Flow Cytometry Staining Buffer,300 ×g离心5分钟,弃上清。
注:液体尽量倒干净,不要有残留。
• 5.每管加入100 μl FIX & PERM Medium B、5 μl Anti-Mouse IFN-γ, PE和5 μl Anti-Mouse IL-4, APC。震荡混匀,室温避光孵育15分钟。
• 6.每管加入 2 ml 1×Flow Cytometry Staining Buffer,300 ×g 离心 5 分钟,弃上清。
• 7.每管加入500μl 1×Flow Cytometry Staining Buffer 重悬,上机检测;或者加入500μl 1 - 4 %多聚甲醛重悬,2 - 8℃避光,于 24 小时内检测。
(3).流式检测
• 1.调节电压和补偿
推荐使用补偿微球(Cat No: 01-1111-41, Thermo Fisher)对流式细胞仪进行电压和补偿调节。
补偿微球通常比目的细胞小,在调节 FSC/SSC 电压和细胞设门时需要注意。
• 2.正确设门以得到 Th1 和 Th2 细胞在 CD3+CD4+辅助 T 细胞中的比例。
注:至少获取 20,000 - 30,000 CD3+CD4+ T 细胞。对于某一细胞因子,因品系和个体差异,分泌该细胞因子的细胞比例差异很大。为了进行统计学差异比较,请获取足够多的细胞样本。需要注意的是,PMA/Ionomycin 刺激的细胞中,分泌 IL-4 的细胞非常低,甚至可忽略。此时,可考虑 IL-4 的极化培养。
(4)结果示例
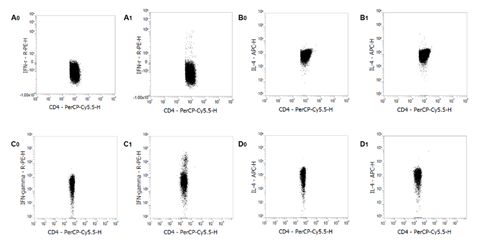
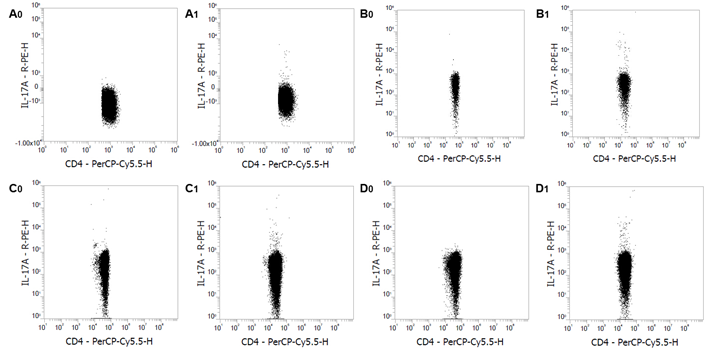
图1:正常 ICR 小鼠的静息肝素抗凝血(A0, B0)、EDTA 抗凝血来源的 PBMCs (C0, D0)、脾细胞(E0, F0)和脾单个核细胞(G0, H0)染色 IFN-γ 和 IL-4。正常ICR 小鼠的 PMA/Ionomycin 刺激的肝素抗凝血(A1, B1)、EDTA 抗凝血来源的 PBMCs (C1, D1) 脾细胞(E1, F1)和脾单个核细胞(G1, H1)染色 IFN-γ 和 IL-4。对 CD3+/CD4+细胞进行设门分析。实验在Thermo Fisher 公司的 Attune NxT 流式细胞仪上进行。
其它相关细胞因子的检测
除 IFN-γ和 IL-4 外,IL-1a、IL-2、IL-6、IL-10、IL-12、GM-CSF和 TNF-α等也是 Th1/Th2所分泌的细胞因子,虽然不是非常特异,但在某些疾病中同样发挥着重要的作用,因此也有检测的必要。
检测这些细胞因子时,要注意所用的刺激剂及刺激方法与 IFN-γ和 IL-4 有所不同,因 PMA+Ionomycin不一定能使这些细胞因子达到最大分泌。所以需参照下表(表1),根据不同的细胞因子,选择最佳的刺激方法。
• 表 1:小鼠 Th1/Th2相关细胞因子的刺激方法
| 细胞因子 | 标本类型 | 刺 激 剂 及 其 剂 量 | 刺激时间 | 再刺激 | 阻断剂 |
| IL-1a | 小鼠PEC | 1) 小鼠 IFN-γ(100ng/ml) | 2hr | Monensin | |
| 小鼠PEC | 2) LPS(100ng/ml) | 22hr | |||
| IL-2 | 小鼠脾脏 | 1) ConA(3ug/ml) | 2d | CD3抗体(10ug/ml immobilized) + CD28抗体(2ug/ml soluble) 5hr |
|
| 小鼠脾脏 | 2) L-2(20ng/ml)+IL-4(20ng/ml) | 3d | |||
| IL-6 | 小鼠脾脏 | 1) ConA(3ug/ml) | 2d | CD3抗体(10ug/ml immobilized) + CD28抗体(2ug/ml soluble) 5hr |
|
| 小鼠脾脏 | 2) IL-2(20ng/ml)+IL-4(20ng/ml) | 3d | |||
| IL-10 | 小鼠脾脏 | 1) ConA(3ug/ml) | 2d | CD3抗体(10ug/ml immobilized) + CD28抗体(2ug/ml soluble) 5hr |
|
| 小鼠脾脏 | 2) IL-2(20ng/ml)+IL-4(20ng/ml) | 3d | |||
| IL-12 | 小鼠PEC | 1)小鼠 IFN-γ(100ng/ml) | 2hr | ||
| 小鼠PEC | 2) LPS(100ng/ml) | 22hr | |||
| GM-CSF | 小鼠脾脏 | 1) ConA(3ug/ml) | 2d | CD3抗体(10ug/ml immobilized) + CD28抗体(2ug/ml soluble) 5hr |
|
| 小鼠脾脏 | 2) IL-2(20ng/ml)+IL-4(20ng/ml) | 3d | |||
| TNF-α | 小鼠脾脏 | 1) ConA(3ug/ml) | 2d | CD3抗体(10ug/ml immobilized) + CD28抗体(2ug/ml soluble) 5hr |
|
| 小鼠脾脏 | 2) IL-2(20ng/ml)+IL-4(20ng/ml) | 3d |
注:PEC: thioglycolate-elicited peritoneal macrophages,巯基乙醇酸钠释放的腹膜举噬细胞;
ConA :刀豆蛋白 A;
LPS:脂多糖;
hr:hour,小时;
d:day,天